خواص ترموديناميكی محلول ليتيوم برومايد – آب (خواص محلول ليتيوم برومايد آب)
ليتيوم برومايد نيز مانند هر نمك ديگري، هنگامي كه در آب حل ميشود باعث تغيير نقطه جوش آب خواهد شد. دماي نقطه جوش اين محلول بستگي به غلظت آن دارد. بعنوان مثال در فشار اتمسفريك، محلولهاي ليتيوم برومايد با غلظت ٥٠ و ٦٠ درصد وزني به ترتيب داراي نقطه جوش ١٣٢ و ١٥٥ درجه سانتيگراد ميباشند. بخار حاصل از جوشيدن محلول، يك بخار آب خالص بوده و دماي آن برابر دماي نقطه جوش محلول است. بعنوان مثال بخار حاصل از جوشيدن محلول با غلظت ٥٠ درصد در فشار اتمسفريك، داراي دماي 132 درجه سانتی گراد بوده و يك بخار داغ ميباشد. در مجموع فشار بخار محلول تابعي از غلظت و دمايي آن بوده و ميتوان مقدار هر يك را با استفاده از مقادير دو كميت ديگر، از نمودار P-T-X تعيين كرد.
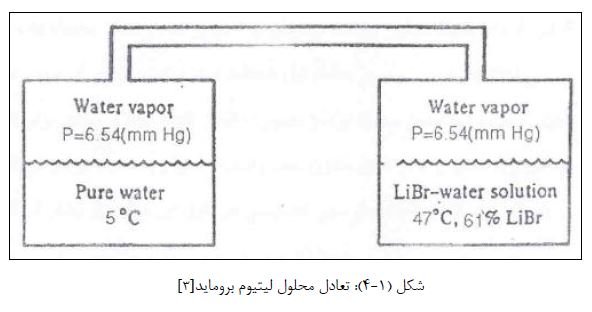
براي بررسي شرايط تعادلي محلول با بخار آب، دو مخزن نشان داده شده در شكل 1-4 را كه به همديگر متصل هستند در نظر بگيريد. در مخزن سمت چپ آب خالص و در مخزن سمت راست محلول ليتيوم برومايد آب قرار داشته و سيستم خلأ شده است. هر يك از اين دو مايع ميتواند داراي يك فشار بخار باشند. در حالت تعادل فشار بخار اعمالي توسط هر دو مايع يكسان خواهند بود. يك نمونه از شرايط تعادلي در شكل 1-4 ارائه شده است. فشار بخار آب خالص در دماي 5 درجه سانتی گراد برابر فشار بخار محلول با غلظت ٦١ درصد و دماي 47 درجه سانتی گراد بوده و برابر 6.54 mmHg ميباشد. لذا دو مايع در يك شرايط تعادلي قرار دارند.
بخار حاصل از تبخير محلول ليتيوم برومايد
بخار حاصل از تبخير محلول ليتيوم برومايد فقط داراي بخار آب و در نتيجه فشار جزئي آب موجود در آن برابر فشار كل بخار (فشار بخار محلول) ميباشد. بنابراين دماي نقطه شبنم محلول و دماي آب خالصي كه در حالت تعادل با محلول قرار دارد يكسان بوده و برابر دماي اشباع آب منطبق بر فشار بخار محلول خواهد بود. در مراجع و نمودارها مقادير اين دما را با عناوين دماي اشباع مبرد (آب) و يا دماي نقطه شبنم محلول ارائه ميدهند. مقدار اين دما روي دياگرام تعادل محلول و در مقابل محور مختصات فشار بخار محلول ارائه ميگردد .
بعنوان مثال دماي اشباع آب در حال تعادل با محلولي كه داراي غلظت ٥٠ درصد و دماي 132 درجه سانتی گراد است، برابر 100 درجه سانتی گراد خواهد بود.
دماي اشباع آب در حال تعادل با محلول
همانگونه كه بيان گرديد دماي اشباع آب در حال تعادل با محلول، برابر دماي نقطه شبنم محلول ميباشد، از اين رو اگر مخزن محلول نشان داده شده در شكل 1-4 سرد شود، فشار بخار محلول در داخل آن كاهش يافته و براي رسيدن به يك شرايط تعادلي جديد، محلول شروع به جذب بخار آب خواهد نمود. در اين فرايند اعمال جذب و تقطير تواماً صورت گرفته و در نهايت بخار آب تقطير شده و به دماي محلول خواهد رسيد. در ادامه بحث تفاوت ميان دو فرآيند جذب و تقطير و در قالب يك مسأله ارائه ميگردد.
فرض كنيد كه مخزن سمت چپ شكل 1-4 بگونه اي است كه آب خالص داخل آن با گرفتن گرماي محيط، به طور پيوسته در دماي 5 درجه سانتی گراد تبخير شده و بخار حاصله به سمت مخزن سمت راست هدايت ميشود. در حالت اول كه فقط فرايند تقطير بخار آب مورد نظر است، مخزن سمت راست بدون محلول بوده و به صورت تقطير كننده عمل مينمايد. براي تقطير بخار آب اشباع با دماي 5 درجه سانتی گراد در داخل مخزن سمت راست، احتياج به محيط سردي ميباشد كه دماي آن بايستي كمتر از 5 درجه سانتی گراد باشد. گرمايي كه بايستي در طول اين فرآيند از بخار آب گرفت تا به مايع اشباع 5 درجه سانتی گراد تبديل شود برابر 2489.6 Kj/Kg (گرماي نهان تبخير آب) ميباشد.
راه دوم تقطير بخار آب
راه دوم تقطير بخار آب مورد نظر، استفاده از محلول جاذب در مخزن سمت راست ميباشد. فرض كنيد كه محلول داخل مخزن قبل از شروع فرايند جذب، داراي غلظت 61 درصد و دماي 47 درجه سانتی گراد بوده و جرم آن 20 kg است. همچنين در نظر بگيريد كه بخار توليدي توسط مخزن سمت چپ به گونه اي است كه هميشه در داخل مخزن محلول، بخار اشباع در فشار 6.54 mmHg وجود داشته و در طول اين فرايند يك كيلوگرم بخار آب توسط محلول جذب ميگردد.
از آنجاييكه سيستم دو جزئي است لذا ميتوان براي حجم كنترل، دو معادله بقاي جرم نوشت. معادله بقاي جرم كلي عبارت است از:
m2 = m1 + mv = 20 +1 (1-4)
جرم محلول پس از جذب عبارت است از:
m2 = 21
معادله بقاي جرم براي جزء ليتيوم برومايد عبارت است از:
X2m2 = X1m1 (2-4)
X2 = 58.1(%)
حال ميتوان با توجه به فشار بخار و غلظت محلول در شرايط ( ٢)، دماي آن را با استفاده از دياگرام تعادلي P-T-X تعيين گردد. در اين صورت مقدار T2 = 41°C به دست مي آيد. مقدار گرمايي كه بايستي براي انجام فرايند فوق از حجم كنترل دفع گردد، شامل مواردي است كه در ادامه مورد بررسي قرار ميگيرند. توجه شود كه ترتيب ذكر شده براي محاسبه مقدار گرماي مورد نظر، هيچگونه ارتباطي به ترتيب و چگونگي انجام فرايند جذب ندارد.
فرايند جذب يك فرايند پيچيدهاي است كه تمام موارد زير به صورت همزمان در طول فرايند روي مي دهند.
1 . گرمايي كه بايستي از سيستم دفع شود تا يك كيلوگرم بخار اشباع آب در دماي 5 درجه سانتی گراد تقطير و به مايع اشباع گردد. اين مقدار گرما برابراست با:
Q1 = mvhfg =1´ 2489.6 = 2489.6KJ (3-4)
2 . افزايش دماي مايع اشباع توليد شده در مرحله قبل از 5 درجه سانتی گراد تا دماي نهايي 41 درجه سانتی گراد كه باعث ايجاد مقداري سرما خواهد شد. لذا بايستي اين مقدار گرما از مقدار ديگر كم شود. مقدار سرمايي كه در اين مرحله ايجاد ميشود برابر است با:
Q2 = mCpDT =1´ 4.186´ (41- 5) =150.7KJ (4-4)
3 . گرماي ديگري كه بايستي از سيستم خارج شود برابر گرمايي است كه بايستي از محلول با غلظت ٦١ درصد، دمايي 47 درجه سانتی گراد و گرماي ويژه 1.77 گرفت تا در غلظت ثابت دماي آن به 41 درجه سانتی گراد كاهش يابد.
اين مقدار گرما برابر است با:
Q3 = mCpDT = 20´1.77(47 – 41) = 212.4KJ (4-5)
4 . گرماي ديگري كه بايستي از سيستم خارج شود مربوط به “گرماي رقيق شدن” محلول ميباشد. مقدار اين گرما در نمودار شكل ضميمه براي مقادير مختلف دما و غلظت محلول ارائه شده است. مقدار گرماي رقيق شدن محلول در برابر مقدار گرمايي است كه هنگام اضافه شدن واحد جرم آب به جرم نامحدود از محلول در دما و غلظت ثابت، آزاد ميشود. به عبارت ديگر مقدار اين گرما بيان كننده تغييرات آنتالپي آب در فرايند جذب ميباشد. از اينرو بايستي اين مقدار گرما نيز از سيستم خارج شود. مقدار گرماي رقيق شدن محلول Hd در شرايط متوسط آن، در غلظت 59.5 درصد و دمای 44 درجه سانتی گراد با توجه به نمودار برابر است با:
158.5(Btu / lb) = 158.2.3255 = 368.6
لذا كل گرماي حل شدن يك كيلوگرم آب در محلول برابر است با:
Q = mvHd =1´ 368.6 = 368.6KJ
بنابراين كل گرمايي كه بايستي از سيستم خارج شود تا فرايند فوق صورت گيرد برابر است با:
Q = Q1 – Q2 + Q3 + Q4
Q = 2489.6 -150.7 + 212.4 + 368.6
Q = 2920KJ
لذا گرماي فرايند جذب در اين مثال 1.173 برابر گرماي فرايند تقطير بخار ميباشد. مزيت صرف اين انرژي بيشتر از آن است كه احتياج به محيط سرد با دماي كمتر از 5 درجه سانتی گراد حذف شده در فرايند جذب ميتوان از محيط سردي با دماي كمتر از 41 درجه سانتی گراد استفاده نمود. اين شرايط را ميتوان به راحتي با جريان آب و يا حتي با جريان هوا نيز فراهم كرد.
براي ساده تر شدن روشن تعيين مقدار گرمايي كه در فرآيند جذب بايستي از واحد جاذب دفع شود و يا تعيين مقدار گرمايي كه در فرآيند جوشش محلول ميبايستي به قسمت مولد بخار تغذيه گردد. نموداري تهيه شده است كه مقدار آنتالپي مخصوص محلول را به دست ميدهد. مقدار آنتالپي نسبت داده شده و به محلول با توجه به مقادير جداول اشباع آب، گرماي رقيق شدن و گرماي ويژه محلول صورت گرفته است. يك نمونه از نمودارهاي h-T-X براي محلول ليتيوم برومايد در شكل ضميمه نشان داده شده است. حالت مرجع براي آنتالپي صفر در اين نمودار، منطبق بر دماي صفر درجه سانتيگراد براي هر دو جزء آب و محلول ٥٠ درصد ميباشد.
استفاده از اين نمودار همراه با جداول اشباع آب، محاسبات بار گرمايي هر يك از قسمتهاي سيستم جذبي را ساده تر مي سازد.
براي نشان دادن طريقه استفاده از اين نمودار، مقدار گرمايي آزاد شده Q در فرايند جذب مثال اخير، مجددًا از اين طريق محاسبه ميگردد.
براي اين منظور لازم است كه مقدار آنتالپي سيالهاي ورودي و خروجي از حجم كنترل مشخص گردند. آنتالپي محلول ورودي با دماي 47 درجه سانتی گراد و غلظت ٦١ درصد، برابر 135 و براي محلول خروجي با دماي 41 درجه سانتی گراد و غلظت 58.1 درصد برابر 2509.5 kj/kg ميباشد. حال با نوشتن معادله بقاي انرژي براي حجم كنترل داريم:
Q = m1h2 – mvhv – m2h2
كه در آن داريم:
m1 = 20Kg
m2 = 21Kg
mv = m31Kg
h1=135 kj/kg
h2=109
hv=2509.5
با جايگذاري مقادير فوق در معادله اخير، بار حرارتي Q بدست مي آيد:
Q = 20*135 +1* 2509.2 – 21*109 = 2920.5KJ
اين روش ساده تر از روش قبل بوده و از آنجاييكه معادله آنتالپي محلول بر حسب دما و غلظت در دسترس ميباشد لذا ميتوان در محاسبات كامپيوتري چرخه ترموديناميكي چيلر جذبي از اين روش و معادلات حاكم آن استفاده كرد.
مطالعه بیشتر در ادامه خصوصيات ماده ليتيوم برومايد ⇐ خصوصيات ماده ليتيوم – برومايد
مطالعه بیشتر ⇐ چیلر جذبی